Дегалогенирование - Dehalogenation
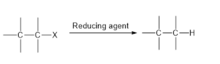
Дегалогенирование представляет собой химическую реакцию, которая включает разрыв связи C-галоген с образованием продукта. Дегалогенирование можно разделить на два подкласса: восстановительное дегалогенирование и гидродегалогенирование.
История
Органические галогениды относятся к классу органических соединений, содержащих связь углерод-галоген. В 1832 году ученый назвал Юстус фон Либих синтезировал первый органический галогенид (древесный уголь) путем хлорирования этанола. С тех пор галогенорганические соединения привлекли к себе большое внимание.[1] Органогалогениды обычно используются в качестве пестицидов, биоразлагаемых веществ, фумигантов почвы, хладагентов, химических реагентов - растворителей и полимеров.[2][3][4] Он был классифицирован как загрязнитель, несмотря на их широкое применение в различных областях. По этой причине дегалогенирование является ключевой реакцией для преобразования токсичных галогенидов в менее опасные продукты.
Скорость дегалогенирования
Среди галогены, фтор наиболее электроотрицательный атом и будет иметь наивысшую тенденцию к образованию самой прочной связи с углеродом. Скорость дегалогенирования зависит от прочности связи между углеродом и атомом галогена. Энергии диссоциации связей углерод-галоген описываются как: H3C-I (234 кДжмоль-1), H3C-Br (293 кДжмоль-1), H3C-Cl (351 кДжмоль-1) и H3C-F (452 кДжмоль-1). -1). Таким образом, для тех же структур скорость диссоциации связи при дегалогенировании будет: F << Cl
[4] Кроме того, скорость дегалогенирования алкилгалогенида также зависит от стерической среды и следует этой тенденции: первичные> вторичные> третичные галогениды.[4]
Дегалогенирование с использованием различных катализаторов
Скорость дегалогенирования зависит от типа субстрата, степени окисления металла и восстанавливающих агентов, используемых во время реакции.
Дегалогенирование с использованием щелочных и щелочно-земельных металлов
Щелочные и щелочноземельные металлы, такие как литий, натрий, калий, магний и кальций, оказались отличными катализаторами дегалогенирования. Во время реакции дегалогенирования металлы действуют как восстановитель, разрушая связи углерод-галоген. Затем галоген может уйти как уходящая группа. Типичный способ синтеза алканов с использованием щелочных и щелочно-земельных металлов показан на схеме 2:
Юс и его сотрудники синтезировали различные соединения нафталинида лития, который действует как катализатор литиирования различных функционализированных галогенированных аренов. Ли-арен реагировал с водой или дейтерием с образованием дегалогенированного продукта.[5][6][7] Основным недостатком использования литий-нафталиновых катализаторов является то, что их трудно отделить от реакционной смеси, поскольку нафталин адсорбируется на поверхности ареновых субстратов. В химии полимеров металлический натрий использовался для процесса дегалогенирования.[8][9]Удаление атома галогена из арен-галогенидов в присутствии агента Гриньяра и воды для образования нового соединения известно как деградация Гриньяра. Дегалогенирование с использованием реактивов Гриньяра представляет собой двухэтапный процесс гидродегалогенирования. Реакция начинается с образования соединения алкил / арен-магний-галоген с последующим добавлением источника протонов с образованием дегалогенированного продукта. Егоров и его сотрудники сообщили о дегалогенировании бензилгалогенидов с использованием атомарного магния в 3P-состоянии при 600 ° C. Толуол и бибензилы были получены как продукт реакции.[10] Мориссон и его сотрудники также сообщили о дегалогенировании органических галогенидов путем мгновенного вакуумного пиролиза с использованием магния.[11]
Дегалогенирование с использованием комплексов переходных металлов 1-го ряда
Многие группы сообщили о процессах дегалогенирования с использованием различных форм гомогенных и гетерогенных комплексов переходных металлов, таких как ОМ, комплексы металл-лиганд, соли металлов и металл, нанесенный на различные носители.[12] Соединения ванадия в его низкой степени окисления имеют тенденцию к реакции дегалогенирования посредством одноэлектронного восстановления. Эффективность системы одноэлектронного переноса зависит от окислительно-восстановительного потенциала ванадиевых комплексов и радикофилов.[13] Литий-хром (I) дигидрид[14] также использовался в качестве универсального восстановителя для дегалогенирования различных алкил- или арилгалогенидов, как показано на схеме 3:

Помимо этих металлов, железо является наиболее изученным металлом для реакции дегалогенирования. Cahiez и его коллеги сообщили о восстановлении бромалкенов с использованием галогенида марганца (II) в присутствии Fe (acac) 3.[15] Вдохновленный этой работой, Мохаммед и его коллеги также выполнили гидробромирование 1,1, -дибром-1-алкенов в присутствии агентов Гриньяра и переходных металлов, таких как Fe и кобальт.[16] Макромолекулы, такие как гематин, кобаламин, витамин B12 и кофермент F430, также используются для дихлорирования полихлорированных этиленов и бензолов. Чарльз и его коллеги сообщили, что витамин B12 и кофермент F430 были способны последовательно дехлорировать тетрахлорэтен до этена, в то время как было продемонстрировано, что гематин дехлорировал тетрахлорэтен до винилхлорида.[17]

Хавьер и его коллеги сообщили о синтезе фторидных комплексов железа (II). Затем комплексы использовали в качестве предшественников и катализаторов гидродефторирования фторуглеродов. Они сообщили о первом синтезе трехкоординированного комплекса фторида железа.[18]

Джаянт и его коллеги разработали двухфазные системы дегалогенирования трихлорэтенов. Кинетическая модель предусматривает, что процесс реакции протекает в одной фазе, а массоперенос между двумя фазами.[19]Было несколько сообщений о процессе дегалогенирования, проводимого с использованием различных других металлов, таких как кобальт, никель, палладий, кремний и германий.[20][2][21]
Рекомендации
- ^ Кляйн, У. Эксперименты, модели, бумажные инструменты: Культуры органической химии в девятнадцатом веке, Stanford University Press: California, 2003, 191-193
- ^ а б Moon, J .; Ли, С. (2009). «Катализируемое палладием дегалогенирование арилхлоридов и бромидов с использованием фосфитных лигандов». J. Organomet. Chem. 694 (3): 473–477. Дои:10.1016 / j.jorganchem.2008.10.052.
- ^ Посуда, G .; Гюнтер, Ф. Обзоры загрязнения окружающей среды и токсикологии, Springer-Verlag: New York, 1998, 155, 1-67.
- ^ а б c Трост, Барри М .; Флеминг, Ян (1991). Комплексный органический синтез - селективность, стратегия и эффективность в современной органической химии. 1–9. Эльзевир. С. 793–809. ISBN 0080359299.
- ^ Ramón, D .; Юс, М. Бишомоенолаты лития в масках: полезные промежуточные соединения в органическом синтезе, J. Org. Chem. 1991, 56, 3825-3831.
- ^ Guijarro, A .; Ramón, D .; Юс, М. Катализируемое нафталином литирование функционализированных хлораренов: региоселективное получение и реакционная способность функционализированных литиоаренов, Tetrahedron, 1993, 49, 469-482.
- ^ Юс, М .; Ramón, D. Катализируемые Ареном реакции лития с литием при низкой температуре, Chem. Comm. 1991, 398-400.
- ^ Хавари, Дж. Региоселективность дехлорирования: восстановительное дехлорирование полихлорбифенилов полиметилгидросилоксаном-щелочным металлом. J. Organomet. Chem. 1992, 437, 91-98.
- ^ Mackenzie, K .; Копинке, Ф.-Д. Дебромирование дуропластовых трудновоспламеняемых полимеров. Chemosphere, 1996, 33, 2423-2428.
- ^ Тараканова, А .; Анисимов, А .; Егоров А.А. Низкотемпературное дегалогенирование бензилгалогенидов атомарным магнием в 3P-состоянии. Российский химический вестник, 1999, 48, 147-151.
- ^ Aitken, R .; Hodgson, P; Oyewale, A. ’Morrison, J. Дегалогенирование органических галогенидов методом мгновенного вакуумного пиролиза над магнием: универсальный метод синтеза. Chem. Commun. 1997, 1163-1164.
- ^ Грушин, В .; Альпер, Х. Активация в противном случае нереактивных связей C-Cl. Вершина. Органомет. Chem. 1999, 3, 193-226.
- ^ Hirao, T .; Hirano, K .; Hasegawa, T .; Oshiro, Y .; Икеда, И. Новая система, состоящая из низковалентного ванадия и диэтилфосфоната или триэтилфосфита для высокостереоселективного восстановления гем-дибромциклопропанов. J. Org. Chem. 1993, 58, 6529-6530
- ^ Eisch, J .; Alila, J. Дигидрид лития и хрома (I): новый реагент для универсального восстановительного метатезиса, восстановительной циклизации, олигомеризации или полимеризации различных органических субстратов. Металлоорганика, 2000, 19, 1211-1213
- ^ Cahiez, G .; Benard, D .; Норман, Дж. Восстановление галогенов, виниликов и ариликов, в частности, магнезиальных органических соединений в присутствии марганца (II). J. Organomet. Chem. 1976, 113, 107-113
- ^ Фахфах, М .; Franck, X .; Hocquemiller, R. ’Figadere, B. Катализируемое железом гидродебромирование 2-арил-1,1-дибром-1-алкенов. J. Organomet. Chem. 2001, 624, 131-135
- ^ Gantzer, C .; Wackett, L. Восстановительное дихлорирование, катализируемое бактериальными коферментами переходных металлов. Environ. Sci. Technol. 1991, 25, 715-722
- ^ Vela, J .; Смит, Дж; Yu, Y .; Ketterer, N .; Flaschenriem, C .; Lachicotte, R .; Холланд П. Синтез и реакционная способность низкокоординированных фторидных комплексов железа (II) и их использование в каталитическом гидродефторировании фторуглеродов. Варенье. Chem. Soc. 2005, 127, 7857-7870
- ^ Gotpagar, J .; Grulke, E .; Bhattacharyya, D .; Восстановительное дегалогенирование трихлорэтилена: кинетические модели и экспериментальная проверка. J. Опасный мат. 1998, 62, 3, 243-264
- ^ Hetflejš, J .; Czakkoova, M .; Rericha, R .; Vcelak, J. Катализируемое дегалогенирование delor 103 гидридоалюминатом натрия. Chemosphere 2001, 44, 1521.
- ^ Kagoshima, H .; Хашимото, Й .; Огуро, Д .; Куцуна, Т .; Сайго, К. Комбинация трофенилфосфина / хлорида германия (IV): новый агент для восстановления производных α-бромкарбоновой кислоты. Тетраэдр, 1998, 39, 1203-1206
