Полный синтез таксола Мукаяма - Mukaiyama Taxol total synthesis

В Полный синтез таксола Мукаяма опубликовано группой Теруаки Мукаяма из Токийский университет науки с 1997 по 1999 год был 6-м успешным общий синтез таксола. В полный синтез из Таксол считается визитной карточкой органический синтез.
Эта версия линейный синтез с образованием кольца, происходящим в порядке C, B, A, D. В отличие от других опубликованных методов, синтез хвоста осуществляется по оригинальной конструкции. Теруаки Мукаяма - эксперт по альдольные реакции и неудивительно, что его версия Taxol содержит не менее 5 таких реакций. Другие ключевые реакции, встречающиеся в этом синтезе: пинаколь муфта и Реформатский реакция. Что касается сырья, каркас C20 построен из L-серин (C3), изомасляная кислота (C4), гликолевая кислота (C2), бромистый метил (C1), метилиодид (C1), 2,3-дибромпропен (C3), уксусная кислота (C2) и гомоаллилбромид (C4).
Синтез С кольцо
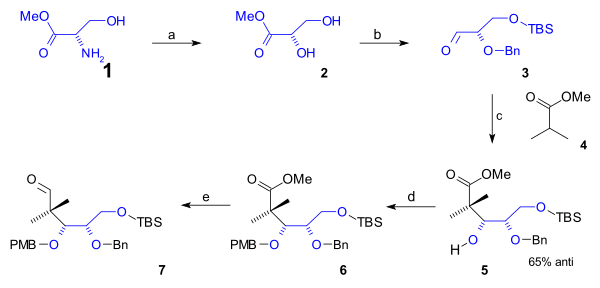
Нижний ободок циклооктан B-кольцо, содержащее первые 5 атомов углерода, было синтезировано в полусинтез начиная с встречающихся в природе L-серин (схема 1). Этот маршрут начался с преобразования амино- группа серинового метила сложный эфир (1) к диол сложный эфир 2 через диазотизация (нитрат натрия /серная кислота ). После защиты группы первичного спирта до (трет-бутилдиметил) TBS силиловый эфир (TBSCl / имидазол ) и группы вторичного спирта с a (Bn) бензиловый эфир (бензилимидат, трифликовая кислота ), альдегид 3 реагировал с метиловым эфиром изомасляная кислота (4) в Добавление альдола к алкоголь 5 с 65% стереоселективность. Эта группа была защищена как PMB (п-метоксибензил) эфир (снова через imidate ) в 6 что позволило органическое восстановление сложного эфира в альдегид в 7 с ДИБАЛ.
 |
| Схема 1 |
|---|
Для завершения циклооктанового кольца потребовалось еще 3 атома углерода, которые были предоставлены фрагментом C2 при присоединении альдола и фрагментом Гриньяра C1 (схема 2). А Добавление альдола Мукаяма (бромид магния / толуол ) занимает место между альдегидом 7 и кетен силилацеталь 8 со стереоселективностью 71% к алкоголю 9 который был защищен как TBS эфир 10 (TBSOTf, 2,6-лутидин ). Сложноэфирная группа восстанавливалась ДИБАЛ до спирта, а затем обратно окисляется до альдегида 11 к Окисление Сверна. Алкилирование бромистый метил магния к алкоголю 12 и другое окисление по Сверну дало кетон 13. Эта группа была преобразована в силиловый эфир енола 14 (LHMDS, TMSCl ) позволяя ему реагировать с NBS к алкилбромид 15. Метильная группа C20 была введена как метилиодид в нуклеофильное замещение с прочной базой (LHMDS в HMPA ) бромид 16. Затем при подготовке к замыканию цикла с эфира TBS была снята защита (HCl /THF ) в спирт, который превратился в альдегид 17 в Окисление Сверна. В реакция замыкания кольца был Реформатский реакция с Йодид самария (II) и уксусная кислота к ацетат 18. Стереохимия этого конкретного этапа не имела значения, потому что ацетатная группа обезвоженный к алкен 19 с DBU в бензол.
 |
| Схема 2 |
|---|
Кольцо синтеза B
Фрагмент C5 24 требуется для синтеза кольца C (схема 3) был приготовлен из 2,3-дибромпропен (20)[1] по реакции с ацетат этила (21), п-бутиллитий и медная соль, а затем органическое восстановление ацетата 22 к алкоголю 23 (литийалюминийгидрид ) и его TES силилирование. Майкл дополнение из 24 с циклооктаном 19 к 25 с т-БуЛи был катализатором цианид меди. После удаления группы TES (HCl, THF) спирт 26 был окислен до альдегида 27 (TPAP, NMO ), что позволило внутримолекулярный Альдольная реакция на велосипеде 28.
 |
| Схема 3 |
|---|
Синтез А кольцо
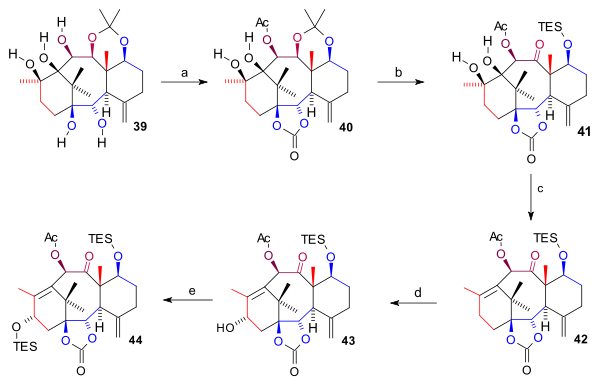
Синтез кольца А (схема 4) началось с сокращения C9 кетон группа в 28 к диол 29 с алан в толуол с последующей защитой диолом в 30 как диметил карбонат. Это позволило селективно окислить спирт С1 с DDQ после снятия защиты до кетона 31. Это соединение алкилировали до 32 по кетонной группе C1 с реакцией Гриньяра гомоаллил бромид магния (Фрагмент C4, завершающий углеродный каркас) и снятая защита по C11 (TBAF ) диол 33. По реакции с циклогексилметилсилилдихлорид обе спиртовые группы участвовали в циклическом силиловом эфире (34), который снова был отщеплен реакцией с метиллитий экспонирование спирта C11 в 35. Замыкание кольца A требовало двух кетоновых групп для пинаколь муфта которые были реализованы окислением спирта C11 (TPAP, NMO) до кетона 36 и Окисление Wacker из аллильной группы в дикетон 37. После образования продукта пинакола 38 бензильные группы (натрий, аммиак ) и триалкилсилильные группы (TBAF) были удалены с образованием пентаола 39.
 |
| Схема 4 |
|---|
Пентаол 39 был защищен дважды: две нижние гидроксильные группы как карбонатный эфир (бис (трихлорметил) карбонат, пиридин ) и гидроксильная группа C10 как ацетат формирование 40. В ацетонид группа была удалена (HCl, THF), гидроксильная группа C7 защищена как силиловый эфир TES, а группа C11 OH окислена (TPAP, NMO) до кетона 41. Затем кольцо диола А удаляли в комбинированном реакция элиминации и Деоксигенация Бартона с 1,1'-тиокарбонилдиимидазол формирование алкен 42. Наконец, гидроксильная группа C15 была введена окислением на аллил положение с двумя шагами PPC и ацетат натрия (в Enone ) и с K-selectride к алкоголю 43 который был защищен как эфир TES в 44.
 |
| Схема 5 |
|---|
Синтез D кольцо
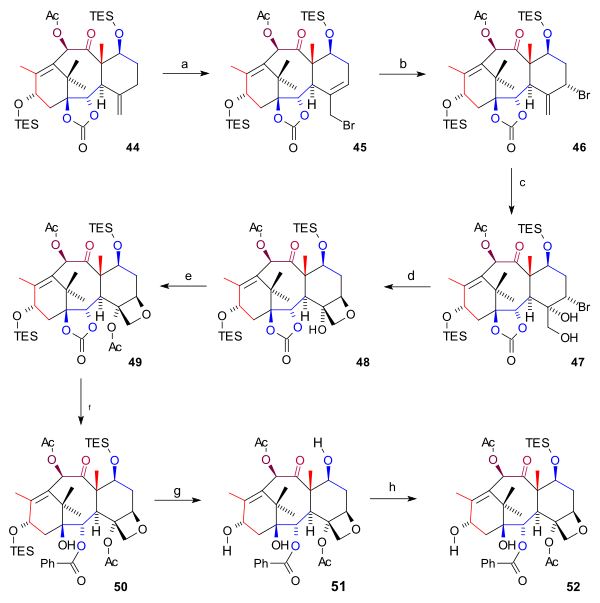
Синтез кольца D (схема 6) началось с 44 с аллильный бромирование с бромид меди (I) и бензоил трет-бутил пероксид бромировать 45. Добавляя еще больше бромида, еще один бромид 46 образовались (оба соединения находятся в химическое равновесие ) с атомом брома в осевой позиция. Четырехокись осмия добавил две гидроксильные группы к экзоциклической двойной связи в диоле 47 и оксетан закрытие кольца на 48 произошло с DBU в нуклеофильное замещение. Затем ацилирование гидроксильной группы C4 (уксусный ангидрид, DMAP, пиридин ) привело к ацетат 49. На последних этапах фениллитий открыла сложноэфирную группу с образованием гидроксикарбоната 50, обе группы TES были удалены (HF, пир ) в триол 51 (баккатин III) и гидроксильная группа C7 была обратно защищена до 52.
 |
| Схема 6 |
|---|
Синтез хвоста
В амид хвостовой синтез (схема 7) был основан на асимметричный Альдольная реакция. Исходное соединение коммерчески доступно. Бензилоксиуксусная кислота 53 который был преобразован в сложный эфир тио 55 (Этантиол ) сквозь хлорангидрид 54 (тионилхлорид, пиридин ). Это сформировало силиловый эфир енола 55 (п-бутиллитий, триметилсилилхлорид, Диизопропиламин ), который реагировал с хиральным аминным катализатором 58, трифлат олова и nBu2(OAc)2 в Добавление альдола Мукаяма с бензальдегид к алкоголь 59 с 99% антиселективностью и 96% ее. Следующий шаг превращения алкогольной группы в амин в 60 был Мицунобу реакция (азид водорода, диэтилазодикарбоксилат, трифенилфосфин с восстановлением азида до амина по Ph3П). Аминогруппу бензоилировали бензоилхлорид (61) и гидролиз удаляет тиоэфирную группу в 62.
 |
| Схема 7 |
|---|
Сложение хвоста
На последних этапах синтеза (схема 8) амидный хвост 62 добавлен в кольцо ABCD 52 в этерификация катализируется о, о'-ди (2-пиридил) тиокарбонат (DPTC) и DMAP формирование сложный эфир 63. Защитная группа Bn была удалена гидрирование с помощью гидроксид палладия на углероде (64) и, наконец, группа TES была удалена HF и пиридин давать таксол 65.
 |
| Схема 8 |
|---|
Смотрите также
- Полный синтез таксола Данишефского
- Общий синтез таксола Холтона
- Полный синтез таксола Kuwajima
- Полный синтез таксола Николау
- Общий синтез паклитаксела
- Полный синтез таксола Вендера
Рекомендации
- Библиография
- Мукаяма, Теруаки (1999). «Асимметричный полный синтез таксола Теруаки Мукаяма, Исаму Шиина, Хаято Ивадаре, Масахиро Сайто, Тосихиро Нисимура, Наото Окава, Хироки Сако, Кодзи Нисимура, Ю-ичиро Тани, Масатоси Хасэгава, Кодзи Ямада, Кацуюки». Chem. Евро. Дж. 5 (1): 121–161. Дои:10.1002 / (SICI) 1521-3765 (19990104) 5: 1 <121 :: AID-CHEM121> 3.0.CO; 2-O.
- Цитаты
- ^ Р. Леспье и М. Бург (1941). «2,3-Дибромпропен». Органический синтез.; Коллективный объем, 1, п. 209
