Пробоподготовка в масс-спектрометрии - Sample preparation in mass spectrometry
Подготовка проб для масс-спектрометрии используется для оптимизации образца для анализа в масс-спектрометр (РС). Каждый метод ионизации имеет определенные факторы, которые необходимо учитывать, чтобы этот метод был успешным, например, объем, концентрация, фаза образца и состав аналит решение. Вполне возможно, что наиболее важным фактором при пробоподготовке является знание того, в какой фазе должна находиться проба, чтобы анализ был успешным. В некоторых случаях сам аналит должен быть очищен перед попаданием в ионный источник. В других ситуациях матрица, или все в растворе, окружающем аналит, является наиболее важным фактором, который необходимо учитывать и корректировать. Часто самой подготовки образца для масс-спектрометрии можно избежать, связав масс-спектрометрию с хроматография метод или какая-либо другая форма разделения перед вводом в масс-спектрометр. В некоторых случаях сам аналит должен быть отрегулирован так, чтобы был возможен анализ, например, в масс-спектрометрия белков, где обычно белок представляющий интерес, перед анализом расщепляется на пептиды либо переваривание в геле или по протеолиз в растворе.
Фаза образца
| Фаза образца | Метод ионизации |
|---|---|
| Твердый | Полевая десорбция |
| Плазменная десорбция | |
| Бомбардировка быстрым атомом (FAB) | |
| Вторичный ион (ВИМС) | |
| Ионизация окружающей среды | |
| Решение | Матричная лазерная десорбционная ионизация (MALDI) |
| Электрораспыление (ESI) | |
| Химическая ионизация при атмосферном давлении (APCI) | |
| Ионизация окружающей среды | |
| Газ | Электронная ионизация |
| Фотоионизация | |
| Химическая ионизация |
Первым и наиболее важным этапом подготовки образца для масс-спектрометрии является определение фазы, в которой должен находиться образец. Для разных методов ионизации требуются разные фазы образца. Образцы твердой фазы можно ионизировать с помощью таких методов, как полевая десорбция, плазменная десорбция, бомбардировка быстрыми атомами, и вторично-ионная ионизация. Жидкости с растворенным в них аналитом или растворы можно ионизировать с помощью таких методов, как матричная лазерная десорбция , ионизация электрораспылением, и химическая ионизация при атмосферном давлении. Как твердые, так и жидкие образцы можно ионизировать ионизация окружающей среды техники.
Образцы газа или летучие образцы можно ионизировать с помощью таких методов, как электронная ионизация, фотоионизация, и химическая ионизация.
Эти списки являются наиболее часто используемыми состояниями вещества для каждого метода ионизации, но методы ионизации не обязательно ограничиваются этими состояниями вещества. Например, ионизация с бомбардировкой быстрыми атомами обычно используется для ионизации твердых образцов, но этот метод обычно используется для твердых веществ, растворенных в растворах, а также может использоваться для анализа компонентов, которые вошли в газовую фазу.[1][2][3]
Хроматография как метод пробоподготовки
Во многих методах ионизации масс-спектрометрии образец должен находиться в жидкой или газовой фазе, чтобы метод ионизации работал. Подготовка образца для обеспечения надлежащей ионизации может быть трудной, но ее можно упростить, если подключить масс-спектрометр к некоторому хроматографическому оборудованию. Газовая хроматография (GC) или жидкостная хроматография (ЖХ) можно использовать в качестве метода подготовки проб.
Газовая хроматография

ГХ - это метод, включающий разделение различных аналитов в пробе смешанных газов. Отделенные газы можно обнаружить несколькими способами, но одним из самых эффективных методов обнаружения в газовой хроматографии является масс-спектрометрия. После отделения газов они попадают в масс-спектрометр и анализируются. Эта комбинация не только разделяет аналиты, но и дает структурную информацию о каждом из них. Образец ГХ должен быть летучий, или может переходить в газовую фазу, при этом будучи термически стабильным, так что он не разрушается при нагревании до перехода в газовую фазу.[4][5] Аналогичные проблемы вызывают методы масс-спектрометрической ионизации, требующие, чтобы образец находился в газовой фазе.
Электронная ионизация (EI) в масс-спектрометрии требует образцов, которые являются небольшими молекулами, летучими и термически стабильными, как и в газовой хроматографии. Это гарантирует, что до тех пор, пока образец не поступит в масс-спектрометр, образец будет подготовлен к ионизации с помощью ЭУ.[6][7]
Химическая ионизация (CI) - еще один метод, при котором образцы должны находиться в газовой фазе. Это сделано для того, чтобы образец мог реагировать с реагент газ с образованием иона, который можно проанализировать с помощью масс-спектрометра. CI предъявляет многие из тех же требований к пробоподготовке, что и EI, например, летучесть и термическая стабильность образца. ГХ также полезен для пробоподготовки в этом методе.[8] Одним из преимуществ CI является то, что с помощью этого метода ионизации можно анализировать более крупные молекулы, разделенные с помощью GC. CI имеет больший диапазон масс, чем EI, и может анализировать молекулы, которые EI не может. ХИ также имеет то преимущество, что меньше повреждает молекулу образца, так что меньше фрагментация происходит и может быть получена дополнительная информация об исходном аналите.[6][9]
Фотоионизация (PI) был методом, который впервые был применен как метод ионизации для обнаружения газов, разделенных с помощью ГХ.[10] Спустя годы его также использовали в качестве детектора для ЖК, хотя образцы должны быть сначала испарены, чтобы их обнаружил фотоионизационный детектор. В конце концов PI был применен к масс-спектрометрии, в частности, как метод ионизации для газовая хроматография-масс-спектрометрия.[11] Подготовка пробы для ИП включает сначала обеспечение того, чтобы проба находилась в газовой фазе. PI ионизирует молекулы, возбуждая молекулы образца фотоны света. Этот метод работает только в том случае, если образец и другие компоненты в газовой фазе возбуждаются разными длины волн света. При подготовке образца или источника фотонов важно, чтобы длины волн ионизации были отрегулированы таким образом, чтобы возбуждать анализируемое вещество образца и ничего больше.[6]
Жидкостная хроматография

Жидкостная хроматография (ЖХ) - это метод, который в некотором смысле более мощный, чем ГХ, но может быть так же легко совмещен с масс-спектрометрией. В ЖХ проблемы, связанные с подготовкой образцов, могут быть минимальными. В ЖХ как стационарная, так и подвижная фаза могут влиять на разделение, тогда как в ГХ только стационарная фаза должна иметь значение. Это позволяет свести к минимуму подготовку образца, если кто-то желает отрегулировать стационарную фазу или подвижную фазу перед анализом образца. Основное внимание уделяется концентрации аналита. Если концентрация слишком высока, разделение может быть безуспешным, но масс-спектрометрия как метод обнаружения не требует полного разделения, что демонстрирует еще одно преимущество сочетания ЖХ с масс-спектрометром.[12]
ЖХ можно связать с масс-спектрометрией за счет испарения жидких образцов, когда они попадают в масс-спектрометр. Этот метод может позволить использовать методы ионизации, которые требуют использования газообразных проб, таких как ХИ или ПИ, особенно химическая ионизация при атмосферном давлении или фотоионизация при атмосферном давлении, которая обеспечивает большее взаимодействие и большую ионизацию.[6][13] Другие методы ионизации могут не требовать испарения жидкого образца и могут анализировать сам жидкий образец. Одним из примеров является ионизация с бомбардировкой быстрыми атомами, которая может позволить жидким образцам, разделенным ЖК, течь в ионизационную камеру и легко ионизироваться.[1] Наиболее распространенным методом ионизации, связанным с ЖК, является некоторая форма ионизации распылением, которая включает ионизацию термораспылением и, чаще, ионизацию электрораспылением (ESI).
Термоспрей был впервые разработан как способ эффективного удаления растворитель и легче испарять образцы. В этом методе жидкая проба из ЖК проходит через испаритель с электрическим обогревом, который просто нагревает пробу, удаляя любой растворитель и, следовательно, переводя пробу в газовую фазу.[14] Электрораспыление ионизация (ESI) похожа на термораспыление по принципу удаления жидкого растворителя из образца в максимально возможной степени, создавая заряженные молекулы образца либо в виде небольших капель, либо в виде газа. Исследования показали, что ESI может быть в десять раз более чувствительным, чем другие методы ионизации, связанные с ЖК.[12] Способы распыления особенно полезны, учитывая, что нелетучие образцы можно легко анализировать с помощью этого метода, поскольку образец сам по себе не превращается в газ, жидкость просто удаляется, переводя образец в газообразную фазу или фазу тумана.[14]
Одна проблема с пробоподготовкой жидкостная хроматография-масс-спектрометрия возможно матрица эффекты из-за наличия фоновых молекул. Было показано, что эти матричные эффекты уменьшают сигнал в таких методах, как PI и ESI, на величину до 60% в зависимости от анализируемого образца. Эффект матрицы также может вызывать усиление сигнала, приводя к ложноположительным результатам. Это можно исправить, максимально очистив образец перед проведением ЖХ, но в случае анализа образцов окружающей среды, когда все в образце вызывает беспокойство, подготовка образца может быть не идеальным решением для устранения проблемы. Другой метод, который можно применить для устранения проблемы, - использовать стандартный метод сложения.[12][15]
Бомбардировка быстрым атомом
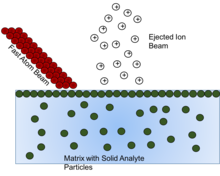
Бомбардировка быстрым атомом (FAB) - метод с использованием луча высокой энергии атомы ударить по поверхности и произвести ионы. Эти твердые частицы аналита должны быть растворены в какой-либо форме матрица, или же энергонезависимый жидкость для защиты и содействия ионизации твердого аналита. Было показано, что по мере истощения матрицы образование ионов уменьшается, поэтому выбор правильного матричного соединения жизненно важен.[16]
Общая цель матричного соединения - представить образец атомному пучку на высокоподвижной поверхности. концентрация. Для максимальной чувствительности образец должен формировать идеальный монослой на поверхности субстрат с низкой волатильностью.[17] Этот монослойный эффект можно увидеть в том, что при достижении определенной концентрации аналита в матрице любая концентрация выше, которая, как видно, не оказывает никакого эффекта, потому что после образования монослоя любой дополнительный аналит оказывается ниже монослоя и, таким образом, не подвержен влиянию атомный пучок. Видно, что концентрация, необходимая для того, чтобы вызвать этот эффект, изменяется по мере изменения количества нелетучей матрицы. Поэтому при приготовлении раствора для анализа необходимо учитывать концентрацию твердого аналита, чтобы не пропустить сигнал от «скрытого» аналита.[17]
Чтобы выбрать матрицу для каждого твердого аналита, необходимо учитывать три критерия. Во-первых, он должен растворить твердое соединение, подлежащее анализу (с помощью сорастворителя или добавки или без них), таким образом позволяя молекулам этого соединения размытый к поверхностным слоям, пополняя образец молекулы которые были ионизированы или разрушены при взаимодействии с пучком быстрых атомов. Другой механизм для объяснения образования ионов в FAB включает идею о том, что распыление происходит из объема, а не с поверхности, но в этом случае растворимость по-прежнему очень важно застраховать однородность твердого аналита в объеме раствора.[16][17] Во-вторых, матрица должна иметь низкую летучесть в условиях масс-спектрометра. Как упоминалось выше, когда матрица истощается, ионизация также уменьшается, поэтому поддержание матрицы жизненно важно. В-третьих, матрица не должна взаимодействовать с рассматриваемым твердым аналитом, или, если она действительно реагирует, это должно происходить понятным и воспроизводимым образом.[16] Это обеспечивает воспроизводимость анализа и идентификацию фактического аналита, а не производная аналита.
Наиболее часто используемые соединения в качестве матрицы представляют собой вариации глицерин, например, глицерин, дейтероглицерин, тиоглицерин, и аминоглицерин. Если образец не может раствориться в выбранной матрице, такой как глицерин, сорастворитель или добавка могут быть смешаны с матрицей для облегчения растворения твердого аналита. Например, хлорофилл А полностью не растворим в глицерине, но при смешивании с небольшим количеством Тритон Х-100, производная от полиэтиленгликоль, хлорофилл становится хорошо растворимым в матрице.[17][18] Важно отметить, что хотя хороший сигнал может быть получен с помощью глицерина или глицерина с добавкой, могут быть и другие матричные соединения, которые могут предложить еще лучший сигнал. Оптимизация матричных соединений и концентрации твердого аналита жизненно важны для измерений FAB.
Масс-спектрометрия вторичных ионов
Масс-спектрометрия вторичных ионов (SIMS) - это метод, очень похожий на метод FAB, в котором пучок частиц направляется на поверхность образца, чтобы вызвать распыление, в котором молекулы образца ионизируются и покидают поверхность, что позволяет анализировать ионы или образец. Основное отличие состоит в том, что в SIMS пучок ионов направляется на поверхность, а в FAB пучок атомов направляется на поверхность. Другое основное отличие, которое представляет больший интерес для этой страницы, заключается в том, что, в отличие от FAB, ВИМС обычно выполняется на твердом образце с небольшой подготовкой образца.[19]
Основное внимание при использовании SIMS - обеспечение стабильности образца при сверхвысокий вакуум, или давления менее 10−8 торр. Природа сверхвысокого вакуума заключается в том, что он обеспечивает постоянство образца во время анализа, а также обеспечивает попадание пучка ионов высокой энергии на образец. Сверхвысокий вакуум решает многие проблемы, которые необходимо учитывать при пробоподготовке.[20] При подготовке образца к анализу следует учитывать еще одну вещь - толщину пленки. Обычно, если тонкий монослой можно нанести на поверхность благородный металл, анализ должен быть успешным.[21] Если толщина пленки слишком велика, что является обычным явлением в реальном анализе, проблема может быть решена такими методами, как нанесение перфорированной серебряной фольги поверх никелевой сетки на поверхность пленки. Это дает аналогичные результаты для тонких пленок, нанесенных непосредственно на благородный металл.[19]
Матричная лазерная десорбция / ионизация
За матричная лазерная десорбция / ионизация (MALDI) масс-спектрометрия: твердый или жидкий образец смешивают с матрица решение, чтобы помочь образцу избежать таких процессов, как агрегирование или же осадки, помогая образцу оставаться стабильным в процессе ионизации.[22][23] Матрица кристаллизуется с образцом и затем наносится на пластину для образца, которая может быть изготовлена из различных материалов, от инертный металлы в инертные полимеры. Затем матрица, содержащая молекулы образца, переносится в газовая фаза импульсным лазер облучение. Состав матрицы, взаимодействие между образцом и матрицей и способ нанесения образца чрезвычайно важны во время подготовки образца для обеспечения наилучших возможных результатов.
Выбор матрицы - это первый шаг при подготовке образцов для анализа MALDI. Основные цели матрицы - поглощать энергию лазера, тем самым передавая ее молекулам анализируемого вещества, и отделить молекулы аналита друг от друга.[24] При выборе матрицы следует учитывать, какой тип иона аналита ожидается или желателен. Знание кислотности или основности молекулы аналита по сравнению, например, с кислотностью или основностью матрицы, является ценным знанием при выборе матрицы. Матрица не должна конкурировать с молекулой аналита, поэтому матрица не должна образовывать ион того же типа, что и аналит. Например, если желаемый аналит имеет высокую кислотность, было бы логично выбрать матрицу с высокой степенью основности, чтобы избежать конкуренции и облегчить образование иона.[25] PH матрицы также можно использовать для выбора образца, для которого вы хотите получить спектр. Например, в случае белков очень кислая pH может показать очень мало пептид компоненты, но может показать очень хороший сигнал для более крупных компонентов. Если pH увеличивается в сторону более щелочного pH, то более мелкие компоненты становятся более заметными.[26]

Концентрация соли в образце также является фактором, который необходимо учитывать при приготовлении образца MALDI. Соли может помочь спектрам MALDI, предотвращая агрегацию или осаждение при стабилизации образца. Однако могут наблюдаться мешающие сигналы из-за побочных реакций матрицы с образцом, например, в случае взаимодействия матрицы с щелочной металл ионы, которые могут ухудшить анализ спектров. Обычно количество соли в матрице становится проблемой только при очень высоких концентрациях, таких как 1 коренной зуб.[23] Проблему слишком высокой концентрации соли в образце можно решить, сначала пропустив раствор через жидкостную хроматографию, чтобы помочь очистить образец, но этот метод требует много времени и приводит к потере части анализируемого образца. Другой метод направлен на очистку после нанесения раствора пробы на пробоотборник. Многие пробоотборные зонды могут иметь мембрану на поверхности, которая может избирательно связывать исследуемый образец с поверхностью зонда. Затем поверхность можно смыть, чтобы удалить все ненужные соли или фоновые молекулы. Затем матрица соответствующей концентрации соли может быть нанесена непосредственно на образец на поверхности зонда и кристаллизована там.[23] Несмотря на эти отрицательные эффекты концентрации соли, отдельный этап обессоливания обычно не требуется в случае белки, потому что выбор подходящего буфер соли предотвращают возникновение этой проблемы.[27]
Как образец и матрица осаждаются на поверхности пробоотборника, также необходимо учитывать при подготовке образца. Метод высушенной капли - самый простой из методов нанесения. Матрица и раствор образца смешивают вместе, а затем небольшую каплю смеси помещают на поверхность зонда для образца и дают высохнуть, таким образом, кристаллизовавшись. Сэндвич-метод включает нанесение слоя матрицы на поверхность зонда и ее высыхание. Затем на слой высушенной матрицы наносят каплю образца, за которой следует капля дополнительной матрицы, и ей также дают высохнуть.[28] Варианты сэндвич-техники включают нанесение матрицы на поверхность, а затем нанесение образца непосредственно на нее. Особенно полезный метод включает нанесение матричного раствора на поверхность пробоотборного зонда в растворителе, который будет испариться очень быстро, образуя очень тонкий тонкий слой матрицы. Затем раствор образца помещают поверх слоя матрицы и дают ему медленно испариться, таким образом интегрируя образец в верхний слой матрицы по мере испарения раствора образца.[29] Дополнительной проблемой при нанесении образца на поверхность зонда является растворимость образца в матрице. Если образец нерастворим в матрице, необходимо использовать дополнительные методы. Используемый в этом случае метод включает механическое измельчение и смешивание твердого образца и кристаллов твердой матрицы. После тщательного перемешивания этот порошок может быть нанесен на поверхность пробоотборника в форме свободного порошка или в виде пилюли. Другой возможный метод - это размещение образца на поверхности зонда и нанесение испаренной матрицы на зонд для образца, чтобы позволить матрице конденсироваться вокруг образца.[30]
Электрораспылительная ионизация
Электрораспылительная ионизация (ESI) - это метод, который включает использование высоких напряжений для создания электроспрей, или штраф аэрозоль создается высоким напряжением.[31] Подготовка пробы ESI может быть очень важной, а качество результатов во многом зависит от характеристик пробы.[32] Эксперименты ESI можно проводить в интерактивном или автономном режиме. При измерениях в режиме онлайн масс-спектрометр подключается к жидкостной хроматограф и когда образцы разделены, они ионизируются в масс-спектрометре системой ESI; Пробоподготовка фактически выполняется перед разделением ЖХ.[33] При автономных измерениях раствор анализируемого вещества подается непосредственно в масс-спектрометр через капиллярную трубку. Автономная подготовка проб имеет много соображений, таких как тот факт, что используемый капилляр позволяет применять объемы в нанолитровом диапазоне, которые могут содержать слишком малую концентрацию для анализа многих соединений, таких как белки. Дополнительной проблемой может быть потеря сигнала ESI из-за интерференции между образцом аналита и фоновыми компонентами. К сожалению, было показано, что пробоподготовка сама по себе может лишь незначительно облегчить эту проблему, которая больше связана с природой самого аналита, чем с приготовлением.[34] В ESI основная проблема возникает не из-за реакций в газовой фазе, а из-за проблем, связанных с фазой растворения самих капель. Проблемы могут быть связаны с нелетучими веществами, остающимися в каплях, которые могут изменять эффективность образования или испарения капель, что, в свою очередь, влияет на количество заряженных ионов в газовой фазе, которые в конечном итоге достигают масс-спектрометра. Эти проблемы могут быть решены несколькими способами, включая увеличение количества концентрации аналита по сравнению с матрицей в растворе образца или путем обработки образца более обширной хроматографической техникой перед анализом.[35][36] Пример хроматографического метода, который может помочь в передаче сигнала в ESI, включает использование 2-мерной жидкостной хроматографии или пропускание образца через два отдельных колонки для хроматографии, что обеспечивает лучшее отделение аналита от матрицы.[37][38]

Варианты ESI

Существуют некоторые методы ESI, которые практически не требуют подготовки проб. Одним из таких методов является метод, называемый экстрактивная ионизация электрораспылением (EESI). Этот метод включает в себя электрораспыление растворителя, направленное под углом против другого распыления раствора образца, производимого отдельным распылителем. Этот метод не требует подготовки образца, так как электрораспыление растворителя извлекает образец из сложной смеси, эффективно удаляя любые фоновые загрязнения.[39] Другой особенно мощный вариант ESI - это десорбция ионизация электрораспылением (DESI), который включает направление электроспрея на поверхность с нанесенным на нее образцом. Образец ионизируется в электроспрее, когда он отрывается от поверхности, а затем попадает в масс-спектрометр. Этот метод важен, потому что для этого метода не требуется пробоподготовка. Образец просто необходимо нанести на поверхность, например на бумагу.[40] Химическая ионизация при атмосферном давлении (APCI) аналогичен ESI в том, что образец распыляется в виде капель, которые затем испаряются, оставляя заряженный ион для анализа. APCI испытывает несколько негативных матричных эффектов, с которыми сталкивается ESI, из-за того, что ионизация происходит в газовой фазе в этом методе, а не внутри жидких капель, как в ESI, и того факта, что в APCI имеется избыток реакционного газа, поэтому минимизация влияния матрицы на процесс ионизации.[41][42]
Белок ESI
Основное применение ESI - это область масс-спектрометрия белков. Здесь МС используется для идентификации и определения размеров белков. Идентификацию образца белка можно выполнить с помощью ESI-MS. de novo пептидное секвенирование (с помощью тандемная масс-спектрометрия ) или же дактилоскопия пептидной массы. Оба метода требуют предварительного расщепления белков до пептидов, в основном осуществляемого ферментативно с использованием протеазы. Как для переваривания в растворе, так и для переваривание в геле Необходимы буферные растворы, содержание солей которых слишком велико, а в аналите слишком мало для успешного измерения ESI-MS. Поэтому выполняется объединенный этап обессоливания и концентрирования. Обычно обращенная фаза жидкостная хроматография используется, в котором пептиды остаются связанными с хроматография матрица, тогда как соли удаляются промыванием. Пептиды могут быть элюированы из матрицы с использованием небольшого объема раствора, содержащего большую часть органический растворитель, что приводит к уменьшению конечного объема аналита. В ЖХ-МС обессоливание / концентрирование осуществляется с помощью предварительной колонки, в автономных измерениях используются обращенно-фазовые микроколонки, которые могут использоваться непосредственно с микролитрами пипетки. Здесь пептиды элюируются распыляемым раствором, содержащим соответствующую порцию органического растворителя. Полученный раствор (обычно несколько микролитров) обогащается аналитом и после переноса в капилляр распылителя может быть непосредственно использован в МС.
Смотрите также
Рекомендации
- ^ а б Каприоли, Ричард М. (1990-04-15). "Непрерывная масс-спектрометрия с бомбардировкой быстрыми атомами". Аналитическая химия. 62 (8): 477A – 485A. Дои:10.1021 / ac00207a715. PMID 2190496.
- ^ Такаяма, Мицуо (21 июля 1995 г.). «Масс-спектрометрия с бомбардировкой быстрыми атомами в газовой фазе». Международный журнал масс-спектрометрии и ионных процессов. 152 (1): 1–20. Bibcode:1996IJMSI.152 .... 1Т. Дои:10.1016/0168-1176(95)04298-9.
- ^ Kralj, B .; Kramer, V .; Врский, В. (1983). "Бомбардировка быстрым атомом молекул в газообразном состоянии". Международный журнал масс-спектрометрии и ионной физики. 46: 399–402. Bibcode:1983IJMSI..46..399K. Дои:10.1016/0020-7381(83)80136-3.
- ^ Джеймс М. Миллер (16 декабря 2005 г.). Хроматография: концепции и контрасты. Джон Вили и сыновья. ISBN 978-0-471-98059-9.
- ^ Монделло, Луиджи; Транчида, Питер Куинто; Дуго, Паола; Дуго, Джованни (2008). «Комплексная двухмерная газовая хроматография-масс-спектрометрия: обзор». Обзоры масс-спектрометрии. 27 (2): 101–124. Bibcode:2008MSRv ... 27..101M. Дои:10.1002 / mas.20158. ISSN 0277-7037. PMID 18240151.
- ^ а б c d Чхабил Дасс (11 мая 2007 г.). Основы современной масс-спектрометрии. Джон Вили и сыновья. ISBN 978-0-470-11848-1.
- ^ Aiken, Allison C .; ДеКарло, Питер Ф .; Хименес, Хосе Л. (2007). "Элементный анализ органических веществ с помощью электронно-ионизационной масс-спектрометрии высокого разрешения". Аналитическая химия. 79 (21): 8350–8358. Дои:10.1021 / ac071150w. ISSN 0003-2700. PMID 17914892.
- ^ Ангероза, Франция; д'Алессандро, Никола; Корана, Федерика; Меллерио, Джорджио (1996). «Характеристика фенольных и секоиридоидных агликонов, присутствующих в оливковом масле первого отжима, методом газовой хроматографии-химической ионизационной масс-спектрометрии». Журнал хроматографии А. 736 (1–2): 195–203. Дои:10.1016 / 0021-9673 (95) 01375-Х. ISSN 0021-9673.
- ^ Филд, Фрэнк Х. (1968). «Химическая ионизационная масс-спектрометрия». Отчеты о химических исследованиях. 1 (2): 42–49. Дои:10.1021 / ar50002a002. ISSN 0001-4842.
- ^ Дрисколл, Джон Н. (1977). «Оценка нового фотоионизационного детектора органических соединений». Журнал хроматографии А. 134 (1): 49–55. Дои:10.1016 / S0021-9673 (00) 82568-6. ISSN 0021-9673.
- ^ Рафаэлли, Андреа; Саба, Алессандро (2003). «Фотоионизационная масс-спектрометрия атмосферного давления». Обзоры масс-спектрометрии. 22 (5): 318–331. Bibcode:2003MSRv ... 22..318R. Дои:10.1002 / mas.10060. ISSN 0277-7037. PMID 12949917.
- ^ а б c Петрович, Мира; Эрнандо, Мария Долорес; Диас-Крус, М. Сильвия; Barceló, Damià (2005). «Жидкостная хроматография – тандемная масс-спектрометрия для анализа остатков фармацевтических препаратов в пробах окружающей среды: обзор». Журнал хроматографии А. 1067 (1–2): 1–14. Дои:10.1016 / j.chroma.2004.10.110. ISSN 0021-9673. PMID 15844508.
- ^ Робб, Дэймон Б.; Кови, Томас Р .; Брюинз, Андрис П. (2000). "Фотоионизация атмосферного давления: метод ионизации для жидкостной хроматографии-масс-спектрометрии". Аналитическая химия. 72 (15): 3653–3659. Дои:10.1021 / ac0001636. ISSN 0003-2700. PMID 10952556.
- ^ а б Blakley, C.R .; Вестал, М. Л. (1983). «Интерфейс термораспыления для жидкостной хроматографии / масс-спектрометрии». Аналитическая химия. 55 (4): 750–754. Дои:10.1021 / ac00255a036. ISSN 0003-2700.
- ^ Бениджтс, Том; Плотины, Риет; Ламберт, Вилли; Де Леенхер, Андре (2004). "Противодействие матричным эффектам в тандемной масс-спектрометрии жидкостной хроматографии и электрораспылительной ионизации в анализе воды для эндокринных разрушающих химикатов". Журнал хроматографии А. 1029 (1–2): 153–159. Дои:10.1016 / j.chroma.2003.12.022. ISSN 0021-9673.
- ^ а б c Гауэр, Джон Левесон (1985). «Матричные соединения для масс-спектрометрии с бомбардировкой быстрыми атомами». Биологическая масс-спектрометрия. 12 (5): 191–196. Дои:10.1002 / bms.1200120502. ISSN 1052-9306.
- ^ а б c d Барбер, Майкл; Бордоли, Роберт С .; Эллиотт, Джеральд Дж .; Седжвик, Р. Дональд; Тайлер, Эндрю Н. (1982). "Масс-спектрометрия с бомбардировкой быстрыми атомами". Аналитическая химия. 54 (4): 645A – 657A. Дои:10.1021 / ac00241a817.
- ^ страница продукта от Shun Chia
- ^ а б Ван Вэк, Люк; Адрианс, Аннеми; Гиджбельс, Ренаат (28 апреля 1999 г.). "Статическая масс-спектрометрия вторичных ионов: (S-SIMS) Часть 1. Методология и структурная интерпретация". Обзоры масс-спектрометрии. 18 (1): 1–47. Bibcode:1999MSRv ... 18 .... 1В. Дои:10.1002 / (sici) 1098-2787 (1999) 18: 1 <1 :: aid-mas1> 3.3.co; 2-n.
- ^ Белу, Анна М .; Грэм, Дэниел Дж .; Кастнер, Дэвид Г. (2003). «Времяпролетная масс-спектрометрия вторичных ионов: методы и приложения для характеристики поверхностей биоматериалов». Биоматериалы. 24 (21): 3635–3653. Дои:10.1016 / S0142-9612 (03) 00159-5. ISSN 0142-9612.
- ^ Беннингховен, Альфред; Хагенхофф, Биргит; Нихуис, Эвальд (1993-07-15). "Поверхностный МС: зондирование образцов реального мира". Аналитическая химия. 65 (14): 630A – 640A. Дои:10.1021 / ac00062a002.
- ^ Fenyo D; Ван Кью; DeGrasse JA; Padovan JC; Каден М; Чайт БТ (2007). «Пробоподготовка MALDI: метод ультратонких слоев». J Vis Exp (3): 192. Дои:10.3791/192. ЧВК 2535834. PMID 18978997.
- ^ а б c Сюй, Инда; Bruening, Merlin L .; Уотсон, Дж. Трок (2003). «Неспецифические методы очистки проб MALDI-MS на зонде». Обзоры масс-спектрометрии. 22 (6): 429–440. Bibcode:2003MSRv ... 22..429X. Дои:10.1002 / mas.10064. ISSN 0277-7037. PMID 14528495.
- ^ Хилленкамп, Франц; Карась, Майкл; Бивис, Рональд С.; Чайт, Брайан Т. (1991). «Матричная лазерная десорбционная / ионизационная масс-спектрометрия биополимеров». Аналитическая химия. 63 (24): 1193A – 1203A. Дои:10.1021 / ac00024a716. ISSN 0003-2700. PMID 1789447.
- ^ Зеноби, Ренато; Knochenmuss, Ричард (1998). «Ионообразование в масс-спектрометрии MALDI». Обзоры масс-спектрометрии. 17 (5): 337–366. Bibcode:1998MSRv ... 17..337Z. Дои:10.1002 / (SICI) 1098-2787 (1998) 17: 5 <337 :: AID-MAS2> 3.0.CO; 2-S. ISSN 0277-7037.
- ^ Коэн, Стивен Л .; Чайт, Брайан Т. (1996). «Влияние условий матричного решения на MALDI-MS анализ пептидов и белков». Аналитическая химия. 68 (1): 31–37. Дои:10.1021 / ac9507956. ISSN 0003-2700. PMID 8779435.
- ^ Смирнов и др., Anal. Chem., 76 (10), S. 2958-2965, 2004.
- ^ Куссманн, Мартин; Нордхофф, Экхард; Рахбек-Нильсен, Хенрик; Хебель, Софи; Россель-Ларсен, Мартин; Якобсен, Лене; Гобом, Йохан; Миргородская, Екатерина; Кролл-Кристенсен, Энн; Пальма, Лизбет; Roepstorff, Питер (1997). «Методы подготовки образцов с использованием матричной лазерной десорбции / ионизационной масс-спектрометрии, разработанные для различных аналитов пептидов и белков». Журнал масс-спектрометрии. 32 (6): 593–601. Bibcode:1997JMSp ... 32..593K. Дои:10.1002 / (SICI) 1096-9888 (199706) 32: 6 <593 :: AID-JMS511> 3.0.CO; 2-D. ISSN 1076-5174.
- ^ Ворм, Оле .; Roepstorff, Питер .; Манн, Матиас. (1994). «Улучшенное разрешение и очень высокая чувствительность в MALDI TOF матричных поверхностей, изготовленных путем быстрого испарения». Аналитическая химия. 66 (19): 3281–3287. Дои:10.1021 / ac00091a044. ISSN 0003-2700.
- ^ Тримпин, С .; Keune, S .; Räder, H.J .; Мюллен, К. (2006). «MALDI-MS без растворителей: разработка улучшений надежности и потенциала MALDI в анализе синтетических полимеров и гигантских органических молекул». Журнал Американского общества масс-спектрометрии. 17 (5): 661–671. Дои:10.1016 / j.jasms.2006.01.007. ISSN 1044-0305. PMID 16540340.
- ^ Хо, CS; Чан МХМ; Cheung RCK; Закон LK; Горит LCW; Ng KF; Suen MWM; Tai HL (февраль 2003 г.). «Масс-спектрометрия с ионизацией электрораспылением: принципы и клиническое применение». Clin Biochem Rev. 24 (1): 3–12. ЧВК 1853331. PMID 18568044.
- ^ Du L; Белый Р.Л. (ноябрь 2008 г.). «Улучшенная модель равновесия разделения для прогнозирования отклика аналита в масс-спектрометрии с ионизацией электрораспылением». J Масс-спектр. 44 (2): 222–9. Bibcode:2009JMSp ... 44..222D. Дои:10.1002 / jms.1501. PMID 19003789.
- ^ Питт, Джеймс Дж (февраль 2009 г.). «Принципы и применение жидкостной хроматографии-масс-спектрометрии в клинической биохимии». Clin Biochem Rev. 30 (1): 19–34. ЧВК 2643089. PMID 19224008.
- ^ Бонфлио, Райан; Кинг, Ричард С .; Olah, Timothy V .; Меркл, Кара (1999). «Влияние методов подготовки образцов на вариабельность отклика ионизации электрораспылением для модельных лекарственных соединений». Быстрые коммуникации в масс-спектрометрии. 13 (12): 1175–1185. Дои:10.1002 / (SICI) 1097-0231 (19990630) 13:12 <1175 :: AID-RCM639> 3.0.CO; 2-0. ISSN 0951-4198.
- ^ Король, Ричард; Бонфлио, Райан; Фернандес-Метцлер, Кармен; Миллер-Штайн, Синтия; Олах, Тимоти (2000). «Механистическое исследование подавления ионизации при ионизации электрораспылением». Журнал Американского общества масс-спектрометрии. 11 (11): 942–950. Дои:10.1016 / S1044-0305 (00) 00163-X. ISSN 1044-0305. PMID 11073257.
- ^ Аннесли, Т. М. (2003). «Подавление ионов в масс-спектрометрии». Клиническая химия. 49 (7): 1041–1044. Дои:10.1373/49.7.1041. ISSN 0009-9147. PMID 12816898.
- ^ Паско, Роб; Фоли, Джо П .; Гусев, Аркадий И. (2001). «Снижение связанных с матрицей эффектов подавления сигналов в масс-спектрометрии с ионизацией электрораспылением с использованием двумерной жидкостной хроматографии в режиме реального времени». Аналитическая химия. 73 (24): 6014–6023. Дои:10.1021 / ac0106694. ISSN 0003-2700. PMID 11791574.
- ^ Тейлор, Пол Дж. (2005). «Матричные эффекты: ахиллесова пята количественной высокоэффективной жидкостной хроматографии – электроспрей – тандемная масс-спектрометрия». Клиническая биохимия. 38 (4): 328–334. Дои:10.1016 / j.clinbiochem.2004.11.007. ISSN 0009-9120. PMID 15766734.
- ^ Чен, Хуанвэнь; Вентер, Андре; Повара, Р. Грэм (2006). «Экстракционная ионизация электрораспылением для прямого анализа неразбавленной мочи, молока и других сложных смесей без пробоподготовки». Химические коммуникации (19): 2042–4. Дои:10.1039 / b602614a. ISSN 1359-7345. PMID 16767269.
- ^ Чен, Хуанвэнь; Пан, Чжэнчжэн; Талаты, Нари; Рафтери, Дэниел; Повара, Р. Грэм (2006). «Сочетание десорбционной масс-спектрометрии с ионизацией электрораспылением и ядерного магнитного резонанса для дифференциальной метаболомики без пробоподготовки». Быстрые коммуникации в масс-спектрометрии. 20 (10): 1577–1584. Дои:10.1002 / RCM.2474. ISSN 0951-4198. PMID 16628593.
- ^ Суверейн, Сандрин; Рудаз, Серж; Veuthey, Жан-Люк (2004). «Матричный эффект в LC-ESI-MS и LC-APCI-MS с автономными и интерактивными процедурами экстракции». Журнал хроматографии А. 1058 (1–2): 61–66. Дои:10.1016 / S0021-9673 (04) 01477-3. ISSN 0021-9673.
- ^ Матушевский, Б. К .; Constanzer, M. L .; Чавес-Энг, К. М. (2003). «Стратегии оценки матричного эффекта в количественных биоаналитических методах на основе ВЭЖХ-МС / МС». Аналитическая химия. 75 (13): 3019–3030. Дои:10.1021 / ac020361s. ISSN 0003-2700. PMID 12964746.
