XDNA - XDNA
 |
| Бензо-гомологированный аденин |
|---|
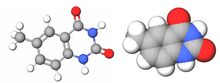 |
| Бензо-омологированный тимин |
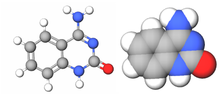 |
| Бензо-гомологированный цитозин |
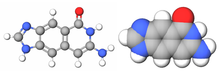 |
| Бензо-омологированный гуанин |
xDNA (также известен как расширенная ДНК или же бензо-гомологированная ДНК) - увеличенный нуклеотид система, синтезированная из слияния бензольное кольцо и одна из четырех естественных баз: аденин, гуанин, цитозин, и тимин.[1] Это увеличение размера дает 8-буквенный алфавит, который имеет большую плотность информации в 2 раза.п по сравнению с естественным ДНК (в литературе часто называют B-ДНК) 4-буквенный алфавит.[2] Как и в обычном спаривание оснований, A пары с xT, C пары с xG, G пары с xC и T пар с xA. В двойная спираль таким образом, 2,4Å шире естественной двойной спирали.[3][4] По своей структуре схожая с B-ДНК, xDNA обладает уникальными свойствами поглощения, флуоресценции и укладки.[5][6][7]
Первоначально синтезирован как фермент Зонд, проведенный группой Нельсона Дж. Леонарда, бензогомологированный аденин был первым синтезированным основанием. Потом, Эрик Т. Кул группа завершила синтез оставшихся трех расширенных базы, в конечном итоге за ней следует яДНК («широкая» ДНК), другая бензогомологированная нуклеотидная система и нафто -гомологированные xxDNA и yyDNA. xDNA более стабильна по сравнению с обычной ДНК при воздействии более высоких температур, и, хотя существуют целые цепи xDNA, yDNA, xxDNA и yyDNA, их в настоящее время трудно синтезировать и поддерживать. Эксперименты с xDNA позволяют по-новому взглянуть на поведение естественной B-ДНК. Расширенные основания xA, xC, xG и xT естественно флуоресцентный, а отдельные цепи, состоящие только из расширенных оснований, могут распознавать и связываться с отдельными цепями естественной ДНК, что делает их полезными инструментами для изучения биологических систем.[3][8] xDNA чаще всего формируется с парами оснований между естественным и расширенным азотистое основание, однако x-азотистые основания также могут быть спарены вместе.[5] Текущие исследования поддерживают xDNA как жизнеспособную систему генетического кодирования в ближайшем будущем.[4]
Происхождение
Первый нуклеотид был расширен пурин аденин. Нельсон Дж. Леонард и его коллеги синтезировали этот оригинальный x-нуклеотид, который получил название «расширенный аденин». xA использовался в качестве зонда при исследовании активные сайты из АТФ -зависимый ферменты, в частности, какие модификации субстрат может занять, оставаясь функциональным.[8][9] Почти два десятилетия спустя три другие базы были успешно расширены и позже интегрированы в двойная спираль к Эрик Т. Кул и коллеги. Их целью было создание синтетической генетической системы, которая имитирует и превосходит функции естественной генетической системы.[10] и расширить область применения ДНК как в живых клетках, так и в экспериментальных биохимия. После создания расширенного базового набора цель сместилась к идентификации или разработке достоверных ферментов репликации и дальнейшей оптимизации расширенного алфавита ДНК.[8]
Синтез
В бензо-гомологированных пуринах (xA и xG) бензольное кольцо привязан к азотистая основа через связи азот-углерод (N-C). Бензо-гомологичные пиримидины образуются за счет углерод-углеродных (C-C) связей между основанием и бензолом.[3] До сих пор х-нуклеиновые основания добавляли к цепям ДНК с использованием фосфорамидит производные, как традиционные полимеразы были безуспешны в синтезе цепей xDNA. X-нуклеотиды - плохие кандидаты в качестве субстратов для полимераз B-ДНК, поскольку их размер мешает связыванию в каталитический домен. Попытки использования независимый от шаблона Ферменты оказались успешными, поскольку они имеют меньшие геометрические ограничения для субстратов. Терминальная дезоксинуклеотидилтрансфераза (TdT) ранее использовался для синтеза цепей оснований, которые были связаны с флуорофоры. С помощью TdT, до 30 мономеры могут быть объединены в двойную спираль xDNA, однако это олигомерный xDNA, по-видимому, ингибирует собственное расширение за пределы этой длины из-за подавляющего образования водородных связей. Чтобы свести к минимуму ингибирование, кДНК можно гибридизировать в регулярную спираль.[7][11]
Репликация
Для использования xDNA в качестве замещающей структуры для хранения информации требуется надежный механизм репликации. Исследование репликации xDNA с использованием Кленовский фрагмент из ДНК-полимераза I показывает, что природное основание-партнер избирательно добавляется в случаях вставки одного нуклеотида. Тем не мение, ДНК-полимераза IV (Dpo4) смог успешно использовать xDNA для этих типов вставок с высокой точностью, что сделало его многообещающим кандидатом для будущих исследований по расширению реплик xDNA.[4] Чувствительность к несоответствию xDNA аналогична чувствительности B-ДНК.[2]
Структура
 |  |  |  |
| Аденин | Тимин | Цитозин | Гуанин |
 |  |  |  |
| Расширенный размер xA | Расширенный размер xT | Развернутый по размеру xC | Расширенный размер xG |
Подобно природным основаниям, x-нуклеотиды избирательно собираются в дуплексную структуру, напоминающую B-ДНК.[4] xDNA была первоначально синтезирована путем включения бензольного кольца в азотистое основание. Однако другие расширенные базы смогли включить тиофен и бензо [b] тиофен также. xDNA и yDNA используют бензольные кольца для расширения оснований и, таким образом, называются «бензогомологированные». Другая форма расширенных азотистых оснований, известная как yyDNA, включает нафталин в основу и являются «омологированными по нафто». xDNA выросла на 3,2Å и поворот на 32 °, что значительно меньше, чем у B-ДНК, которая имеет подъем на 3,3Å и поворот на 34,2 °[3] Нуклеотиды xDNA могут встречаться на обеих цепях - либо по отдельности (известная как «дважды расширенная ДНК»[8]) или смешанные с натуральными основами - или исключительно на одной или другой пряди. Подобно B-ДНК, xDNA может распознавать и связывать комплементарные одноцепочечные ДНК или же РНК последовательности.[2]
Дуплексы, образованные из кДНК, похожи на натуральные дуплексы помимо расстояния между двумя сахарно-фосфатными цепями. Спирали xDNA имеют большее количество пар оснований на виток спирали в результате уменьшения расстояния между соседними нуклеотидами. Спектры ЯМР показывают, что спирали хДНК антипараллельны, правша и взять анти конформация вокруг гликозидная связь, с сахарной сморщивкой C2'-endo.[5][11] Спирали, созданные из xDNA, с большей вероятностью принимают конформацию B-спирали, а не конформацию A-спирали,[2] и имеют увеличенную ширину основной канавки на 6,5Å (где позвонки наиболее удалены друг от друга) и уменьшили ширину малой канавки на 5,5Å (где магистрали расположены ближе всего) по сравнению с B-ДНК. Изменение ширины бороздки влияет на способность xDNA связываться с ДНК-связывающие белки,[12] но пока расширенный нуклеотиды являются эксклюзивными для одной цепи, сайты узнавания достаточно похожи на B-ДНК чтобы позволить склеивание факторы транскрипции и маленький полиамид молекулы. Смешанные спирали дают возможность узнавать четыре расширенных основания с использованием других ДНК-связывающих молекул.[11]
Характеристики
Расширенные нуклеотиды и их олигомерные спирали имеют много общих свойств с их естественными B-ДНК аналоги, включая их предпочтения при сопряжении: А с Т, C с грамм.[11] Различные различия в химических свойствах между xDNA и B-ДНК поддерживают гипотезу о том, что бензольное кольцо который расширяет x-нуклеиновые основания, на самом деле химически не инертен.[5] xDNA больше гидрофобный чем B-ДНК,[7] а также имеет меньший HOMO-LUMO промежуток (расстояние между самой высокой занятой молекулярной орбиталью и самой низкой незанятой молекулярной орбиталью) в результате модифицированного насыщенность.[3] xDNA имеет более высокие температуры плавления, чем B-ДНК (смешанный декамер xA и T имеет температуру плавления 55,6 ° C, что на 34,3 ° C выше, чем тот же декамер A и T[11]) и демонстрирует поведение плавления "все или ничего".[2]
Конформация
В лабораторных условиях xDNA ориентируется в син конформация. Это, к сожалению, не подвергает связывающую поверхность нуклеотидов кДНК лицом к соседней цепи для связывания, а это означает, что необходимо применять дополнительные меры для изменения конформации кДНК перед попыткой образования спиралей. Тем не менее анти и син ориентации практически идентичны энергетически в расширенных базах.[9] Это конформационное предпочтение проявляется прежде всего в пиримидины, и пурины отображать минимальное предпочтение ориентации.[5]
Улучшенная укладка
Укладка нуклеотиды в двойная спираль является основным фактором стабильности спирали. С добавленным площадь поверхности и водород доступный для связывания, потенциал стэкинга азотистых оснований увеличивается с добавлением бензол распорка. Увеличивая расстояние между азотистые основания и либо сахарно-фосфатная основа, энергия упаковки спирали менее изменчива и, следовательно, более стабильна. Энергии для естественных пар азотистых оснований варьируются от 18 до 52 кДж / моль. Эта дисперсия составляет всего 14-40 кДж / моль для хДНК.[8]
Из-за повышенного перекрытия и расширения прядей ДНК и соседней нити, в расширенных и смешанных спиралях наблюдаются более сильные межцепочечные взаимодействия, что приводит к значительному увеличению стабильности спирали. xDNA обладает улучшенными способностями к укладке в результате изменений меж- и внутрицепочечных водородная связь которые возникают в результате добавления бензол спейсер, но расширение оснований не изменяет вклад водорода в стабильность дуплекса. Эти способности к наложению используются спиралями, состоящими как из кДНК, так и из B-ДНК для того, чтобы оптимизировать прочность спирали. Повышенная укладка особенно заметна в прядях, состоящих только из А и xA и Т и xT, поскольку Т -xA имеет более сильное взаимодействие стекирования, чем Т -А.[3]
Энергия, возникающая из пиримидины колеблется в пределах 30–49 кДж / моль. Ассортимент для пурины составляет 40-58 кДж / моль. При замене одного нуклеотида в двойной спирали на расширенный нуклеотид сила стэкинг-взаимодействий увеличивается на 50%. Расширение обоих нуклеотидов приводит к увеличению силы укладки на 90%. В то время как xG в целом оказывает отрицательное влияние на силу связывания спирали, другие три расширенных основания перевешивают это своими положительными эффектами. Изменение энергии, вызванное расширением оснований, в основном зависит от вращение облигации о азотистых основаниях ' центры масс, и взаимодействия стэкинга центра масс улучшают стэкинг-потенциал спирали.[5] Поскольку увеличенные в размерах основания расширяют спираль, она более термически стабильна с более высокой температурой плавления.[7]
Абсорбция
Добавление бензол распорка в x-азотистые основания влияет на базы ' оптическое поглощение спектры. Теория функционала плотности, зависящая от времени (TDDFT), примененный к xDNA, показал, что бензольный компонент самых высоких занятых молекулярных орбиталей (HOMO ) в x-основаниях фиксирует начало поглощения в более ранней точке, чем естественный базы. Еще одна необычная особенность спектров поглощения xDNA - красный сдвиг. эксимеры xA в нижнем диапазоне. С точки зрения наложения отпечатков пальцев более выраженная гипохромность наблюдается в последовательных xA-Т пар оснований.
Последствия измененной абсорбции xDNA включают приложения в наноэлектронные технологии и нанобиотехнология. Уменьшение расстояния между x-нуклеотидами делает спираль жестче, поэтому на него не так легко повлиять субстрат, электрод, и функциональный наночастица силы. Прочие переделки натурального нуклеотиды приводящие к различным спектрам поглощения, в будущем расширит возможности этих приложений.[6]
Флуоресценция
Одно уникальное свойство xDNA - это присущее ей флуоресценция. Натуральные основания можно привязать непосредственно к флуорофоры для использования в микрочипы, на месте гибридизация, и полиморфизм анализ. Однако эти флуоресцентные природные основы часто выходят из строя в результате самозатухающий, что снижает интенсивность их флуоресценции и снижает их применимость в качестве визуальных тегов ДНК. В пи взаимодействия между кольцами в x-азотистых основаниях приводят к внутреннему флуоресценция в фиолетово-синем диапазоне, с Стоксов сдвиг между 50–80 нм. У них также есть квантовый выход в диапазоне 0,3–0,6. xC имеет наибольшее флуоресцентное излучение.[10][7]
Другие расширенные базы
После создания и успешного исследования, связанного с xDNA, было исследовано больше форм расширенных нуклеотидов. yDNA - вторая подобная система нуклеотидов, в которой используется бензольное кольцо расширить четыре натуральные основы. xxDNA и yyDNA использование нафталин, полициклическая молекула, состоящая из двух углеводород кольца. Два кольца расширяют основу еще больше, изменяя ее химические свойства.
yDNA

Успех и значение xDNA побудили исследования изучить другие факторы, которые могут изменить B-ДНК химические свойства и создать новую систему для хранения информации с более широкими приложениями. yDNA также использует бензольное кольцо, аналогично xDNA, с той лишь разницей, что сайт добавления ароматическое кольцо. Расположение бензольное кольцо изменяет предпочтительную структуру расширенной спирали. Измененная конформация делает яДНК более похожей на B-ДНК в своей ориентации путем изменения межпрядного водородные связи. Стабильность сильно зависит от вращения оснований вокруг связи между основанием и сахаром позвоночника. Измененное предпочтение yDNA этой ориентации делает ее в целом более стабильной, чем xDNA. Расположение бензол распорка также влияет на геометрию канавки основания, изменяя взаимодействие между соседями. Пары оснований между y-нуклеотидами и природными нуклеотидами плоские, а не слегка скрученные, как в случае xDNA. Это уменьшает рост спираль даже дальше, чем достигается с помощью xDNA.
В то время как xDNA и yDNA очень похожи по большинству свойств, включая их повышенное взаимодействие при укладке, yDNA демонстрирует превосходное распознавание несовпадений. y-пиримидины демонстрируют немного более сильные взаимодействия стекирования, чем x-пиримидины, в результате расстояния между двумя аномерный углерода, который немного больше в yDNA. xDNA по-прежнему имеет более сильные взаимодействия стэкинга в модельных спиралях, но добавление x- или y-пиримидинов к естественным двойная спираль усиливает внутри- и межцепочечные взаимодействия, увеличивая общую стабильность спирали. В конце концов, какое из двух взаимодействий будет наиболее сильным, зависит от последовательность; xT и yT связываются А с аналогичной силой, но энергия упаковки yC связана с грамм сильнее xC на 4 кДж / моль. yDNA и другие расширенные основания являются частью очень молодой области, которая очень мало изучена. Исследования показывают, что идеальное строение еще предстоит обнаружить, но зная, что бензол расположение влияет на ориентацию и структуру расширенных азотистых оснований, добавляя информацию для их будущего дизайна.[8]
yyDNA и xxDNA
Двукратно расширенный (или нафто-омологированный) азотистые основания включают нафталин распорка вместо бензольное кольцо, расширяя основание вдвое благодаря своей двукольцевой структуре. Эти структуры (известные как xxDNA и yyDNA) составляют 4,8Å шире чем натуральные основы и снова были созданы в результате исследования Леонарда расширенных аденин в АТФ -зависимый ферменты в 1984 году. Никакой литературы по этим дважды расширенным базам не публиковалось в течение почти трех десятилетий до 2013 года, когда первый xxG был выпущен Sharma, Lait и Wetmore и включен вместе с xxA в естественная спираль. Хотя по xxDNA было проведено очень мало исследований, xx-пурин Уже было показано, что соседи увеличивают энергию внутрицепочечной упаковки до 119% (по сравнению с 62% в x-пуринах). хх-пурин и пиримидин взаимодействия показывают общее уменьшение энергии упаковки, но общая стабильность дуплексы в том числе пиримидинов и х-пуринов увеличивается на 22%, более чем в два раза, чем пиримидинов и х-пуринов.[9]
Использует
xDNA находит множество применений в химических и биологических исследованиях, включая расширение применения естественных ДНК, например строительные леса. Для создания самосборных наноструктур необходим каркас как своего рода решетка для поддержки роста. ДНК использовалась в качестве средства для этой цели в прошлом, но расширенные каркасы делают более крупные каркасы для более сложной самосборки.[1] xDNA электрическая проводимость свойства также делают его главным кандидатом в качестве молекулярная проволока, поскольку его π-π взаимодействия помочь ему эффективно проводить электричество.[3] Его 8-буквенный алфавит (А, Т, C, грамм, xA, xT, xC, xG) дает ему возможность хранить 2п раз больше плотности хранения, где п представляет количество букв в последовательность. Например, объединение 6 нуклеотидов с B-ДНК дает 4096 возможных последовательностей, тогда как комбинация того же количества нуклеотидов, созданная с помощью xDNA, дает 262 144 возможных последовательности. Кроме того, xDNA можно использовать в качестве флуоресцентного зонда на ферменте. активные сайты, как и его первоначальное приложение Леонарда и др.[2]
xDNA также применялась для изучения белок-ДНК взаимодействия. Благодаря естественной флуоресцентный свойства, это может быть легко визуализировано как в лабораторных, так и в бытовых условиях.[5] xDNA становится проще создавать и олигомеризовать, и его связывание с высоким сродством к дополнительный ДНК и РНК Последовательности означают, что он может не только помочь найти эти последовательности, плавающие в ячейке, но также и тогда, когда они уже взаимодействуют с другими структурами внутри ячейки.[10] xDNA также имеет потенциальное применение в анализах, в которых используются TdT так как это может улучшить репортеров и может использоваться как тег сходства для межниточного склеивания.[7]
Смотрите также
- ДНК
- РНК
- Секвенирование ДНК
- Генная инженерия
- Нанобиотехнологии
- Нуклеооснование
- ДНК Хатимодзи
- Искусственно расширенная система генетической информации (AEGIS)
Рекомендации
- ^ а б Линч С.Р., Лю Х., Гао Дж., Кул Э.Т. (ноябрь 2006 г.). «На пути к разработанной, функционирующей генетической системе с парами оснований увеличенного размера: структура решения двойной спирали xDNA из восьми оснований». Журнал Американского химического общества. 128 (45): 14704–11. Дои:10.1021 / ja065606n. ЧВК 2519095. PMID 17090058.
- ^ а б c d е ж Гао Дж, Лю Х., Кул Э.Т. (май 2005 г.). «Сборка полной восьмиосновной искусственной генетической спирали, xDNA, и ее взаимодействие с естественной генетической системой». Angewandte Chemie. 44 (20): 3118–22. Дои:10.1002 / anie.200500069. PMID 15834852.
- ^ а б c d е ж грамм Fuentes-Cabrera M, Zhao X, Kent PR, Sumpter BG (август 2007 г.). «Электронная структура xDNA». Журнал физической химии B. 111 (30): 9057–61. Дои:10.1021 / jp0729056. PMID 17650925.
- ^ а б c d Крюгер А.Т., Лу Х., Хойланд Т., Лю Х., Гао Дж., Кул Э.Т. (01.09.2008). «На пути к репликации xDNA, неестественной генетической системы увеличенного размера». Серия симпозиумов по нуклеиновым кислотам. 52 (1): 455–6. Дои:10.1093 / nass / nrn231. PMID 18776450.
- ^ а б c d е ж грамм МакКоннелл Т.Л., Ветмор С.Д. (март 2007 г.). «Каким образом увеличенные в размерах нуклеотидные основания ДНК повышают стабильность дуплекса? Вычислительный анализ водородных связей и способности оснований xDNA к укладке». Журнал физической химии B. 111 (11): 2999–3009. Дои:10.1021 / jp0670079. PMID 17388411.
- ^ а б Варсано Д., Гарбеси А., Ди Феличе Р. (декабрь 2007 г.). "Ab initio спектры оптического поглощения расширенных размеров базовых сборок xDNA". Журнал физической химии B. 111 (50): 14012–21. Дои:10.1021 / jp075711z. PMID 18034470.
- ^ а б c d е ж Ярчоу-Чой С.К., Крюгер А.Т., Лю Х., Гао Дж., Кул Е.Т. (март 2011 г.). «Флуоресцентные нуклеотиды xDNA как эффективные субстраты для матрично-независимой полимеразы». Исследования нуклеиновых кислот. 39 (4): 1586–94. Дои:10.1093 / nar / gkq853. ЧВК 3045586. PMID 20947563.
- ^ а б c d е ж Лайт Л.А., Рутледж Л.Р., Миллен А.Л., Ветмор С.Д. (октябрь 2008 г.). «yDNA против пиримидиновых нуклеиновых оснований xDNA: вычислительные доказательства зависимости стабильности дуплекса от расположения спейсера». Журнал физической химии B. 112 (39): 12526–36. Дои:10.1021 / jp805547p. PMID 18771305.
- ^ а б c Шарма П., Лайт Л.А., Ветмор С.Д. (октябрь 2013 г.). «Изучение границ расширения азотистых оснований: вычислительный дизайн нафто-гомологированных (xx-) пуринов и сравнение с природными пуринами и пуринами xDNA». Физическая химия Химическая физика. 15 (37): 15538–49. Bibcode:2013PCCP ... 1515538S. Дои:10.1039 / c3cp52656a. PMID 23942832.
- ^ а б c Крюгер А.Т., Лу Х., Ли А.Х., Кул Э.Т. (февраль 2007 г.). «Синтез и свойства ДНК с увеличенным размером: в сторону сконструированных функциональных генетических систем». Отчеты о химических исследованиях. 40 (2): 141–50. Дои:10.1021 / ar068200o. ЧВК 2539066. PMID 17309194.
- ^ а б c d е Хекель А (июнь 2004 г.). «Новый аналог ДНК увеличенного размера и объема». ChemBioChem. 5 (6): 765–7. Дои:10.1002 / cbic.200400001. PMID 15174157. S2CID 26157871.
- ^ Варгезе М.К., Томас Р., Унникришнан Н.В., Сударсанакумар С. (май 2009 г.). «Моделирование молекулярной динамики xDNA». Биополимеры. 91 (5): 351–60. Дои:10.1002 / bip.21137. PMID 19137576. S2CID 38901164.
